- CDC tanulmány a COVID-19 vakcina további adagjának biztonsági ellenőrzéséről
- Amit már ismert a themlékeztető lövés?
- A 306 Pfizer-BioNTech klinikai vizsgálatban résztvevő résztvevő között a 3. dózis utáni mellékhatások hasonlóak voltak a 2. dózis utáni mellékhatásokhoz.
Mit ad hozzá ez a jelentés a CDC által ma közzétett 3. felvételen?
12. augusztus 19. és szeptember 2021. között azon 12,591 3 v-biztonságos regisztráló között, akik az mRNS COVID-19 vakcina mindhárom adagja után egészségügyi ellenőrzést végeztek, 79.4%, illetve 74.1% helyi vagy szisztémás reakciót jelentett. harmadik adag; 77.6%, illetve 76.5% jelentett helyi vagy szisztémás reakciót a második adag után.
Milyen következményekkel jár a közegészségügyi gyakorlat?
A v-safe önkéntes jelentései nem találtak váratlan mellékhatásokat a COVID-19 vakcina további adagja után. A CDC továbbra is figyelemmel kíséri a vakcina biztonságát, beleértve a további COVID-19 dózisokat is.
12. augusztus 2021-én az Élelmiszer- és Gyógyszerügyi Hatóság (FDA) módosította a Pfizer-BioNTech és a Moderna COVID-19 vakcinákra vonatkozó sürgősségi felhasználási engedélyeket (EUA-k), hogy engedélyezze az elsődleges oltási sorozat befejezése után egy további adag beadását jogosult személyeknek. közepesen súlyos vagy súlyos immunhiányos állapotok (1,2). 22. szeptember 2021-én az FDA engedélyezett egy további adag Pfizer-BioNTech vakcinát az elsődleges sorozat befejezése után, legalább 6 hónappal a 65 évnél idősebb, a súlyos COVID-19 kockázatának kitett személyek körében, vagy akik munkahelyi vagy intézményi expozíciója miatt nagy a COVID-19 veszélye (1). A Pfizer-BioNTech által végzett, 3. fázisú klinikai vizsgálat eredményei, amelyekben 306 18–55 év közötti személy vett részt, azt mutatták, hogy a mellékhatások a 5 dózisú elsődleges mRNS-vakcinázási sorozat befejezése után 8–2 hónappal beadott harmadik adag beadása után hasonlóak voltak a a 2. adag bevétele után jelentettek; ezek a mellékhatások közé tartoztak az enyhe vagy mérsékelt injekció beadási hely és szisztémás reakciók (3). A CDC kifejlesztett egy v-safe-t, egy önkéntes, okostelefonon alapuló biztonsági felügyeleti rendszert, amely tájékoztatást nyújt a COVID-19 oltás utáni mellékhatásokról.
Véletlenül egy további dózis engedélyezésével az immunhiányos állapotú személyek számára a v-safe platformot frissítették, hogy a regisztrálók bevihessenek információkat a kapott COVID-19 vakcina további dózisairól. 12. augusztus 19. és szeptember 2021. között összesen 22,191 19 v-biztonságos regisztráló jelentette be, hogy további adag COVID-97.6 elleni védőoltást kapott. A legtöbben (2%) elsődleges 3 dózisú mRNS oltási sorozatról számoltak be, amelyet ugyanazon vakcina harmadik adagja követett. Azok körében, akik mindhárom adag esetében (12,591 58.1; 79.4%) egészségügyi ellenőrzést végeztek, 74.1% és 3% jelentett helyi vagy szisztémás reakciót a 77.6. dózis után, míg 76.5% és 2% jelentett helyi vagy szisztémás reakciót Ezek a kezdeti megállapítások nem utalnak arra, hogy a COVID-19 vakcina további adagja után nem várt mellékhatások alakulnak ki; a legtöbb ilyen mellékhatás enyhe vagy közepes volt. A CDC továbbra is figyelemmel kíséri a vakcina biztonságát, beleértve a COVID-19 vakcina további adagjainak biztonságát, és adatokat szolgáltat a vakcinázási ajánlások irányításához és a közegészség védelméhez.
A V-safe egy önkéntes, okostelefon-alapú amerikai biztonsági felügyeleti rendszer; az oltott személyek, akik jogosultak engedélyezett vagy engedélyezett oltóanyag-termék fogadására, regisztrálhatnak a v-safe-ben. A v-safe platform lehetővé teszi a meglévő regisztrálók számára, hogy jelentést tegyenek egy további adag COVID-19 vakcina befogadásáról, az új regisztrálók pedig a beérkezett COVID-19 vakcina minden adagjáról. A V-biztonságos egészségügyi felméréseket a vakcina minden egyes adagja utáni 0–7. Napon küldik, és a helyi injekció beadási helyére, valamint a szisztémás reakciókra és az egészségre gyakorolt hatásokra vonatkozó kérdéseket tartalmaznak.† A Vakcina Mellékhatások Jelentési Rendszerének (VAERS) munkatársai kapcsolatba lépnek a regisztrálókkal, akik jelzik, hogy az oltás után orvosi ellátást kértek, és ha szükséges, bátorítják vagy megkönnyítik a VAERS jelentés elkészítését.§
A v-biztonságos regisztrálók körében, akik 19. augusztus 12. és szeptember 19. között további COVID-2021 vakcina adag beérkezéséről számoltak be, a 0–7. Napon jelentett demográfiai adatokat, helyi és szisztémás reakciókat, valamint az egészségre gyakorolt hatásokat oltási minták szerint írták le (pl. , az egyes adagokhoz kapott vakcina gyártója). Azokat a személyeket, akik arról számoltak be, hogy elsődleges sorozatot kaptak különböző gyártóktól vagy olyan gyártótól, amely ismeretlen vagy nem volt elérhető az Egyesült Államokban, vagy 2 adag vakcinát kapott egy egyszeri Janssen (Johnson & Johnson) vakcina (150) kézhezvétele után mellékhatások a kiegészítő adag bevétele után.
Az elsődleges oltási sorozat befejezésétől a további adag bevételéig eltelt időt az oltási mintával írták le. A 2. és 3. dózis utáni mellékhatásprofilokat összehasonlítottuk azoknál a regisztrálóknál, akik ugyanaztól a gyártótól kapták a mRNS oltást mind a 3 dózishoz.¶ Az elemzések elvégzéséhez SAS szoftvert (9.4 -es verzió; SAS Institute) használtak. Ezeket a felügyeleti tevékenységeket a CDC felülvizsgálta, és a vonatkozó szövetségi törvényeknek és a CDC -irányelvnek megfelelően hajtotta végre. **
12. augusztus 19. és szeptember 2021. között összesen 22,191 19 v-biztonságos regisztráló jelentette be, hogy az elsődleges sorozat befejezése után további adag COVID-XNUMX elleni védőoltást kapott (Táblázat 1). Közülük 14,048 63.3 (30%) nő volt, és körülbelül 18% -uk 49–50, 64–65 és 74–XNUMX éves.
A legtöbb regisztráló (21,662 97.6; 98.6%) arról számolt be, hogy ugyanaztól a gyártótól kapta a harmadik adagot, mint az elsődleges mRNS-oltóanyag-sorozat, beleértve a Moderna-betegek 98.2% -át és a Pfizer-BioNTech-betegek 341% -át. Kevés regisztráló (1.5; 10%) számolt be elsődleges mRNS vakcina sorozatról, amelyet egy másik gyártó mRNS oltóanyagának további dózisa követett, egy dózis Janssen vakcina az elsődleges mRNS oltási sorozat beérkezése után (0.05; 19%), vagy további dózisú COVID-178 vakcina bármely gyártótól a Janssen vakcina után (0.8; XNUMX%).
A 22,191 19 v-biztonságos regisztráló között az elsődleges COVID-182 oltási sorozat befejezésétől a további adag bevételéig eltelt medián időtartam 160 nap volt (interkvartilis tartomány [IQR] = 202–XNUMX nap) (Táblázat 2). Azok között, akik 2 adag Janssen vakcinát kaptak, az adagok közötti intervallum rövidebb volt (84 nap; IQR = 16–136 nap).
Helyi (16,615 74.9; 15,503%) és szisztémás (69.9 19; 15,761%) reakciókról számoltak be gyakran a héten a COVID-71.0 elleni vakcina további adagja után, leggyakrabban az oltást követő napon. Gyakran jelentett reakciók az injekció beadásának helyén jelentkező fájdalom (12,429 56.0; 9,636%), fáradtság (43.4 XNUMX; XNUMX%) és fejfájás (XNUMX; XNUMX%).
A 22,191 7,067 további dózist kapó személy közül összesen 31.8 (28.3%) számolt be egészségügyi hatásokról, és körülbelül 6,287% (401) arról számolt be, hogy nem tudja elvégezni a szokásos napi tevékenységeket, leggyakrabban az oltást követő napon. Orvosi ellátást 1.8 (0.1%) regisztráló kért, tizenhárom (XNUMX%) pedig kórházba került. A v-safe felmérésben nem azonosították az orvosi ellátás vagy a kórházi kezelés okát; mindazonáltal azok a regisztrálók, akik jelzik, hogy az oltás után orvoshoz fordultak, felveszik a kapcsolatot a VAERS munkatársaival, és arra ösztönzik őket, hogy töltsék ki a VAERS jelentést.
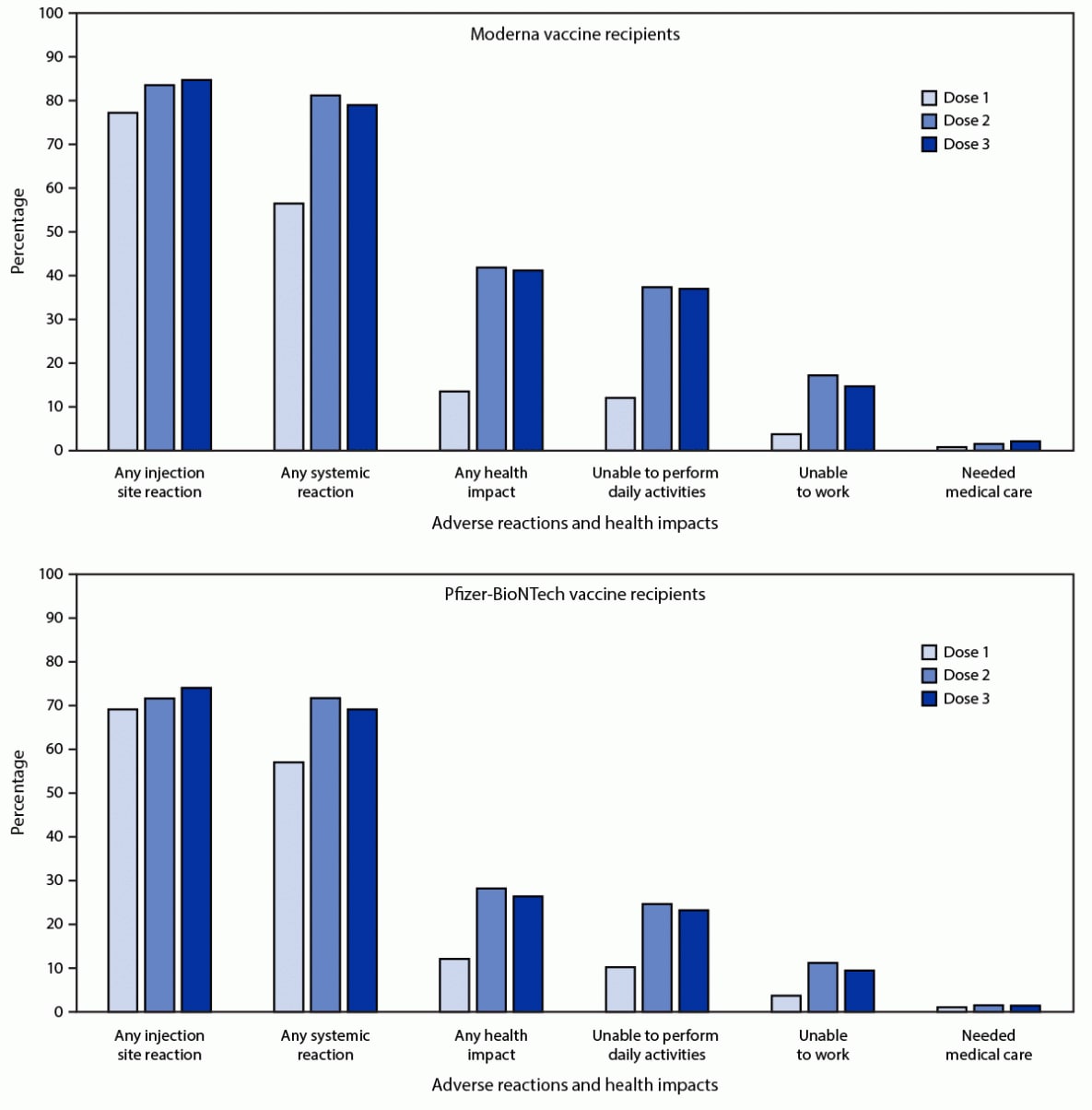
A 21,658 3 v-biztonságos regisztráló közül, akik mindhárom adag esetében ugyanazt az mRNS-oltást kapták, 12,591 58.1-en (0%) végeztek legalább egy egészségügyi ellenőrzést a 7–3. Napon mindhárom adag után; 79.4% és 74.1% jelentett helyi vagy szisztémás reakciókat a 3. adag után, míg 77.6% és 76.5%, akik helyi vagy szisztémás reakciókat jelentettek a 2. dózis után. A regisztrálók között, akik 3 adag Moderna -t kaptak (6,283) a 3. dózis után gyakrabban jelentettek reakciókat, mint a 2. dózist (5,323; 84.7% és 5,249; 83.5%; p-érték = 0.03) (Ábra). A szisztémás reakciókat ritkábban jelentették a 3. adag után, mint a 2. dózist (4,963; 79.0% és 5,105; 81.3%; p-érték <0.001).
Azoknál a regisztrálóknál, akik 3 adag Pfizer-BioNTech-t kaptak (6,308), a 3. dózis után gyakrabban jelentettek helyi reakciókat, mint a 2. dózist (4,674; 74.1% és 4,523; 71.7%; p-érték <0.001). A szisztémás reakciókat ritkábban jelentették a 3. adag után, mint a 2. dózist (4,363; 69.2% és 4,524; 71.7%; p-érték <0.001). Azok körében, akik fájdalomról számoltak be az mRNS vakcina 3. adagja után, a legtöbb reakció enyhe (4,909 51.4; 4,000%) vagy mérsékelt (41.9; 637%) volt; súlyos fájdalmat (a mindennapi tevékenységeket megnehezítő vagy lehetetlenné tevő fájdalom) 6.7 (XNUMX%) jelentett.
Megbeszélés
19. szeptember 2021-ig az Egyesült Államokban körülbelül 2.21 millió ember kapott további adag COVID-19 vakcinát†† elsődleges sorozat befejezése után. 12. augusztus 19. és szeptember 2021. között nem észleltek váratlan mellékhatások mintázatát azoknak a 22,191 v-biztonságos regisztrálónak, akik további dózist kaptak a COVID-19 vakcinától. A legtöbb bejelentett helyi és szisztémás reakció enyhe vagy közepes, átmeneti volt, és leggyakrabban a vakcinázást követő napon számoltak be. A legtöbb regisztráló, aki további dózist kapott, egy elsődleges mRNS -vakcinázási sorozatról számolt be, majd egy harmadik adagot ugyanaztól a gyártótól.
A Pfizer-BioNTech klinikai vizsgálat, amelyben 306 18–55 éves személy vett részt, azt mutatta, hogy a 3. dózis utáni reakciók hasonlóak a 2. dózis után jelentettekhez (3). A v-biztonságos adatok elemzése azonban azt találta, hogy a Pfizer-BioNTech 3. adagja után a helyi reakciók valamivel gyakoribbak, a szisztémás reakciók ritkábbak voltak.
A Moderna vakcina vagy a Pfizer-BioNTech 3. dózisa után megfigyelt mellékhatások mintái összhangban voltak a 2. dózis beadása után korábban leírt reakciókkal
Azon regisztrálók száma, akik jelezték, hogy 2 adag Janssen -vakcinát kaptak, vagy további adagjukat az elsődleges sorozat gyártójától eltérő gyártótól kapták, kicsi volt, ami korlátozott minden következtetést.
A különböző gyártók COVID-19 vakcina termékeivel történő oltás biztonságosságára vagy hatékonyságára vonatkozó adatok korlátozottak; az immunizálási gyakorlatok tanácsadó bizottsága (ACIP) azt javasolja, hogy a mérsékelten vagy súlyosan immunhiányos állapotú személyek kapjanak egy harmadik adag mRNS COVID-19 vakcinát ugyanattól a gyártótól, mint elsődleges sorozatuk.
A CDC további adagokra vonatkozó ajánlásai jelenleg nem tartalmazzák azokat a személyeket, akik megkapták a Janssen vakcinát.
A tanulmány által lefedett időszakban az ACIP ajánlásai a COVID-19 vakcina további adagjára csak mérsékelten vagy súlyosan immunhiányos állapotú személyekre korlátozódtak, akik
2 adag mRNS vakcina.
Egy immunhiányos hemodialízisben szenvedő betegek körében végzett vizsgálat arról számolt be, hogy a Pfizer-BioNTech vakcina 3. adagját követően a helyi és szisztémás reakciók hasonlóak voltak a 2. adagot követően.¶¶ A legutóbbi jelentések a vakcinázott személyek fertőzéséről és a fertőzések gyakoriságának növekedése a SARS-CoV-1.617.2 B.2 (Delta) változatával, a COVID-19-et okozó vírussal a vakcinázott személyek körében, néhány embert arra késztethettek, hogy keressenek egy további adag az ajánlásokon kívül. A medián intervallum az elsődleges sorozat befejezésétől a további adag bevételéig körülbelül 6 hónap volt; ezért a COVID-19 vakcinák bevezetése során kiemelt fontosságú személyek, beleértve az egészségügyi dolgozókat és az idősebb felnőtteket, további adagot kaphattak.
A jelentés megállapításaira legalább négy korlátozás vonatkozik. Először is, a v-safe-be való jelentkezés önkéntes, és valószínűleg nem reprezentálja az oltott amerikai lakosságot; a résztvevők többsége fehérnek és nem spanyolnak vallotta magát. Másodszor, ebben a vizsgálati időszakban a további adagolási ajánlásokat az immunhiányos állapotú személyekre korlátozták, akik befejezték az elsődleges mRNS COVID-19 oltási sorozatot; a v-safe azonban nem tartalmaz információkat az immunrendszer állapotáról.
A további dózisban részesülők valószínűleg olyan személyek, akik immunhiányos állapotokkal rendelkeznek és nincsenek. Harmadszor, az ok-okozati összefüggés a vakcina és a vakcinázás után jelentett klinikailag súlyos mellékhatás között nem állapítható meg v-biztonságos adatok felhasználásával. Végül nem állt rendelkezésre elegendő adat a mellékhatások mintázatának meghatározásához, miután az elsődleges sorozattól eltérő gyártótól vagy a Janssen vakcina kiegészítő dózisát megkapták.
További dózis mRNS COVID-19 vakcina ajánlott mérsékelten vagy súlyosan immunhiányos állapotú személyek számára (5).
A CDC további adag Pfizer-BioNTech vakcinát ajánlott az elsődleges vakcinázási sorozat befejezése után ≥6 hónappal ≥65 éves korú személyek, tartós ápolású lakosok és 50–64 éves, alapbetegségben szenvedők körében; A 18-49 éves, alapbetegségben szenvedő személyek és a 18-64 éves személyek, akiknek foglalkozási vagy intézményi környezetük miatt fokozott a COVID-19-expozíció és -átvitel kockázata, további előnyöket és kockázatokat kaphatnak
A> 22,000 3 v-biztonságos regisztráló biztonsági adatainak kezdeti elemzése azt mutatja, hogy a helyi reakciók kissé fokozódnak, és a szisztémás reakciók enyhén csökkennek az mRNS 2. dózisa után, mint a XNUMX. dózis után.
A nemkívánatos reakciók váratlan mintáit nem azonosították; a jelentettek enyhe vagy közepes fokúak és átmenetiek voltak. A CDC továbbra is figyelemmel kíséri a COVID-19 vakcina további adagjainak biztonságosságát. A különböző oltóanyag -kombinációkhoz kapcsolódó mellékhatásokra és az elsődleges sorozat befejezése óta eltelt időre vonatkozó további adatok fontosak lesznek a népegészségügyi ajánlások irányításához.
| Jellegzetes | Moderna, %† (n = 10,601 XNUMX) | Pfizer-BioNTech, %† (n = 11,412 XNUMX) | Janssen, %†, § (n = 178 XNUMX) | Végösszeg (N = 22,191) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Dózis 3 Moderna (n = 10,453; 98.6%) | 3. adag Pfizer-BioNTech (n = 144; 1.4%) | Dózis 3 Janssen (n = 4; 0.04%) | 3. adag Pfizer-BioNTech (n = 11,209; 98.2%) | Dózis 3 Moderna (n = 197; 1.7%) | Dózis 3 Janssen (n = 6; 0.1%) | Dózis 2 Janssen (n = 48; 27.0%) | Dózis 2 Moderna (n = 64; 36.0%) | 2. adag Pfizer-BioNTech (n = 66; 37.1%) | ||
| Szex | ||||||||||
| nő | 63.8 | 63.9 | 50.0 | 63.0 | 63.5 | 33.3 | 39.6 | 57.8 | 59.1 | 63.3 |
| férfi | 35.1 | 34.0 | 50.0 | 36.1 | 36.0 | 66.7 | 60.4 | 42.2 | 40.9 | 35.7 |
| ismeretlen | 1.0 | 2.1 | 0 | 0.9 | 0.5 | 0 | 0 | 0 | 0 | 1.0 |
| Korcsoport, év | ||||||||||
| 0-17 | 0.0 | 0.7 | 0.0 | 0.6 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.3 |
| 18-49 | 25.7 | 36.1 | 25.0 | 31.5 | 42.6 | 50.0 | 54.2 | 60.9 | 57.6 | 29.1 |
| 50-64 | 28.4 | 27.1 | 50.0 | 31.1 | 29.9 | 0.0 | 33.3 | 34.3 | 30.3 | 29.8 |
| 65-74 | 33.9 | 27.1 | 0.0 | 27.8 | 21.3 | 50.0 | 10.4 | 4.7 | 9.1 | 30.5 |
| 75-84 | 10.9 | 9.0 | 25.0 | 8.3 | 5.6 | 0.0 | 2.1 | 0.0 | 3.0 | 9.5 |
| ≥85 | 1.1 | 0.0 | 0.0 | 0.7 | 0.5 | 0.0 | 0.0 | 0.0 | 0.0 | 0.9 |
| Bőrszín | ||||||||||
| Spanyol / latin | 8.0 | 15.3 | 0 | 8.2 | 5.6 | 0 | 25.0 | 6.3 | 10.6 | 8.2 |
| Nem spanyol/latin | 87.7 | 81.9 | 100 | 87.6 | 90.9 | 100 | 54.2 | 89.1 | 89.4 | 87.6 |
| ismeretlen | 4.3 | 2.8 | 0 | 4.2 | 3.6 | 0 | 20.8 | 4.7 | 0 | 4.2 |
| Futam | ||||||||||
| AI/AN | 0.5 | 0.7 | 0 | 0.5 | 0.5 | 0 | 2.1 | 0 | 0 | 0.5 |
| ázsiai | 4.9 | 5.6 | 0 | 6.1 | 7.1 | 0 | 2.1 | 14.1 | 13.6 | 5.6 |
| Fekete | 5.6 | 3.5 | 0 | 6.2 | 1.5 | 16.7 | 6.3 | 6.3 | 9.1 | 5.9 |
| NHPI | 0.2 | 0 | 0 | 0.3 | 0.5 | 0 | 4.2 | 0 | 0 | 0.3 |
| fehér | 82.6 | 82.6 | 100 | 80.4 | 85.8 | 66.7 | 56.3 | 71.9 | 69.7 | 81.4 |
| többnemzetiségű | 1.9 | 2.1 | 0 | 1.8 | 1.5 | 16.7 | 4.2 | 4.7 | 3.0 | 1.9 |
| Más | 2.1 | 4.2 | 0 | 2.1 | 0.5 | 0 | 6.3 | 1.6 | 3.0 | 2.1 |
| ismeretlen | 2.3 | 1.4 | 0 | 2.5 | 2.5 | 0 | 18.8 | 1.6 | 1.5 | 2.4 |
rövidítések: AI/AN = amerikai indián/alaszkai bennszülött; NHPI = őshonos hawaii vagy más csendes -óceáni szigetlakó.
* Azon regisztrálók százalékos aránya, akik a vakcinázást követő 0–7. Napon legalább egy v-biztonságos állapotfelmérést végeztek.
† Elsődleges oltási sorozat.
§ Ide tartoznak azok a személyek, akik a felsorolt gyártóktól elsődleges egyszeri Janssen és 1 további adag vakcinát kaptak.
| Reakció | Moderna, %† (n = 10,477 XNUMX) | Pfizer-BioNTech, %† (n = 11,284 XNUMX) | Janssen, %†, § (n = 174 XNUMX) | Végösszeg (N = 22,191) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Dózis 3 Moderna (n = 10,453; 98.6%) | 3. adag Pfizer-BioNTech (n = 144; 1.4%) | Dózis 3 Janssen (n = 4; 0.04%) | 3. adag Pfizer-BioNTech (n = 11,209; 98.2%) | Dózis 3 Moderna (n = 197; 1.7%) | Dózis 3 Janssen (n = 6; 0.1%) | Dózis 2 Janssen (n = 48; 27.0%) | Dózis 2 Moderna (n = 64; 36.0%) | 2. adag Pfizer-BioNTech (n = 66; 37.1%) | ||
| Napok az első sorozat óta, medián (IQR) | 182 (164 - 198) | 183 (161 - 204) | 173 (141 - 182) | 183 (157 - 209) | 186 (161 - 217) | 123 (113 - 182) | 84 (16 - 136) | 156 (140 - 164) | 150 (136 - 167) | 182 (160 - 202) |
| Bármilyen reakció az injekció beadásának helyén | 80.9 | 64.6 | 75.0 | 69.4 | 81.7 | 83.3 | 25.0 | 70.3 | 80.3 | 74.9 |
| Viszketés | 20.0 | 11.8 | 0 | 8.4 | 10.2 | 16.7 | 10.4 | 6.3 | 7.6 | 13.9 |
| Fájdalom | 75.9 | 60.4 | 75.0 | 66.6 | 80.2 | 83.3 | 20.8 | 68.8 | 74.2 | 71.0 |
| Vörösség | 25.2 | 8.3 | 0 | 9.8 | 20.8 | 16.7 | 6.3 | 7.8 | 12.1 | 17.1 |
| Duzzanat | 33.6 | 17.4 | 0 | 16.8 | 30.5 | 16.7 | 6.3 | 12.5 | 18.2 | 24.8 |
| Bármilyen szisztémás reakció | 75.2 | 59.7 | 50.0 | 65.1 | 76.1 | 100 | 31.3 | 68.8 | 63.6 | 69.9 |
| Hasi fájdalom | 8.4 | 3.5 | 0 | 6.4 | 8.1 | 16.7 | 4.2 | 3.1 | 6.1 | 7.3 |
| izomfájás | 49.8 | 29.2 | 0 | 36.3 | 49.2 | 50.0 | 20.8 | 45.3 | 33.3 | 42.7 |
| Hidegrázás | 31.3 | 8.3 | 50.0 | 17.5 | 33.5 | 50.0 | 8.3 | 23.4 | 10.6 | 24.1 |
| Hasmenés | 9.9 | 7.6 | 0 | 9.0 | 9.6 | 16.7 | 8.3 | 6.3 | 9.1 | 9.4 |
| Fáradtság | 61.8 | 44.4 | 0 | 51.0 | 60.9 | 83.3 | 14.6 | 48.4 | 50.0 | 56.0 |
| Láz | 36.4 | 20.1 | 50.0 | 22.2 | 37.1 | 50.0 | 6.3 | 37.5 | 12.1 | 29.0 |
| Fejfájás | 49.0 | 31.1 | 0 | 38.4 | 49.7 | 83.3 | 18.8 | 35.9 | 40.9 | 43.4 |
| Ízületi fájdalom | 33.0 | 18.8 | 0 | 23.0 | 31.0 | 33.3 | 16.7 | 20.3 | 19.7 | 27.7 |
| Hányinger | 18.8 | 10.4 | 25.0 | 13.6 | 21.3 | 33.3 | 8.3 | 9.4 | 18.2 | 16.1 |
| Kiütés | 2.3 | 0.7 | 0 | 1.9 | 2.5 | 0 | 4.2 | 1.6 | 1.5 | 2.1 |
| Hányás | 2.2 | 2.1 | 25.0 | 1.4 | 2.0 | 0 | 2.1 | 0 | 0 | 1.7 |
| Bármilyen egészségügyi hatás | 39.2 | 19.4 | 0 | 25.2 | 39.1 | 33.3 | 16.7 | 28.1 | 24.2 | 31.8 |
| Nem tudja elvégezni a szokásos napi tevékenységeket | 35.2 | 18.1 | 0 | 22.1 | 33.0 | 33.3 | 10.4 | 25.0 | 15.2 | 28.3 |
| Nem tud dolgozni vagy iskolába járni | 13.7 | 4.9 | 0 | 9.0 | 21.3 | 16.7 | 10.4 | 6.3 | 13.6 | 11.3 |
| Szükség volt orvosi ellátásra | 2.1 | 1.4 | 0 | 1.5 | 3.0 | 0 | 6.3 | 0 | 0 | 1.8 |
| Telehealth | 0.9 | 0.7 | 0 | 0.7 | 1.0 | 0 | 2.1 | 0 | 0 | 0.8 |
| Klinika | 0.7 | 0.7 | 0 | 0.6 | 0.5 | 0 | 4.2 | 0 | 0 | 0.6 |
| Sürgősségi látogatás | 0.2 | 0 | 0 | 0.2 | 0 | 0 | 4.2 | 0 | 0 | 0.2 |
| Kórházi ápolás | 0.05 | 0 | 0 | 0.1 | 0 | 0 | 0 | 0 | 0 | 0.1 |
ÁBRA. Mellékhatások és egészségkárosító hatások, amelyeket olyan személyek jelentettek, akik 3 adag* Moderna (N = 6,283 6,308) vagy Pfizer-BioNTech (N = 19 0) COVID-7 vakcinát kaptak, és legalább egy v-biztonságos állapotfelmérést végeztek el a 12– 19 minden egyes adag után, dózisszám szerint - Egyesült Államok, 2021. augusztus XNUMX. - szeptember XNUMX
MIT KELL ELVENI A CIKKBŐL:
- Results from a phase 3 clinical trial conducted by Pfizer-BioNTech that included 306 persons aged 18–55 years showed that adverse reactions after receipt of a third dose administered 5–8 months after completion of a 2-dose primary mRNA vaccination series were similar to those reported after receipt of dose 2.
- Persons who reported receiving a primary series from different manufacturers or a manufacturer that was unknown or unavailable in the United States, or 2 doses of vaccine after receipt of a Janssen (Johnson &.
- On August 12, 2021, the Food and Drug Administration (FDA) amended Emergency Use Authorizations (EUAs) for the Pfizer-BioNTech and Moderna COVID-19 vaccines to authorize administration of an additional dose after completion of a primary vaccination series to eligible persons with moderate to severe immunocompromising conditions (1,2).